Metalli e non metalli non sono due fanbase di generi musicali, ma una divisione degli elementi della tavola periodica.
Per essere più precisi la divisione è tra metalli, semimetalli e non metalli. Queste categorie corrispondono a tre zone distinte del sistema periodico.
Infatti abbiamo la zona degli elementi metallici da sinistra al centro (la più popolata), quella degli atomi non metallici a destra e quella dei semimetalli (o metalloidi) in diagonale tra centro e destra (la meno popolata).
Questa categorizzazione è strettamente collegata alle proprietà periodiche (le abbiamo viste in questo articolo).
Infatti, il raggio atomico, l’elettronegatività e l’affinità elettronica hanno lo stesso andamento lungo la tavola periodica. Ciò significa che, per esempio, i metalli tendono ad avere raggio atomico più grande ed elettronegatività più bassa rispetto agli atomi non metallici.
Vediamo un esempio pratico.
Stai facendo alcuni esercizi per il test di medicina e trovi una domanda tipo “Lo zinco, nella tavola periodica, dove si colloca tra le categorie metalliche?”.
Ah boh, panico 😱.
Chill, vediamo insieme come ragionare.
Grazie alle nostre tecniche di memoria ti ricordi che la sua energia di ionizzazione è relativamente bassa (906,4 kJ/mol).
Ottimo! Utilizzare le proprietà periodiche ti permette di capire dov’è collocato un elemento. In questo caso la posizione dell’elemento è tra rame e gallio (al limite del terzo gruppo).
Il valore dell’energia di ionizzazione indica che l’atomo di zinco tende a perdere facilmente gli elettroni del suo ultimo livello energetico.
Tale caratteristica lo rende un elemento abbastanza reattivo.
Approfondiamo la tematica e facciamo un po’ di chiarezza per capire a quale categoria associare gli atomi più reattivi o stabili.

Qual è la differenza tra metalli e non metalli?
Come abbiamo visto, la divisione della tavola periodica in categorie è un modo per organizzare gli elementi in gruppi con proprietà simili.
Ciò ci permette di comprendere meglio le proprietà periodiche e utilizzarle per prevedere il comportamento degli atomi in diverse situazioni.
Partiamo dalle basi.
Abbiamo detto che nella parte sinistra è collocata la maggior parte degli elementi.
Il raggio atomico di questi atomi diminuisce lungo un periodo (da sinistra a destra), ma aumenta lungo un gruppo (dall’alto verso il basso).
Sono caratterizzati da bassi livelli di energia di ionizzazione e quindi tendono a perdere facilmente gli elettroni di valenza.
Lungo un gruppo il valore energetico diminuisce (verso il basso il valore è minore), ma aumenta lungo un periodo.
Ciò significa che gli atomi metallici sono più reattivi man mano che andiamo da sinistra a destra, ma diventano più stabili quando andiamo verso la parte alta della tavola periodica.
L’affinità elettronica e l’elettronegatività in questa categoria hanno valori bassi (o addirittura negativi nel caso dell’ae). Ciò ci porta a dire che gli atomi metallici non sono inclini a guadagnare elettroni e che, al contrario, tendono a perdere elettroni durante la formazione di un legame chimico.
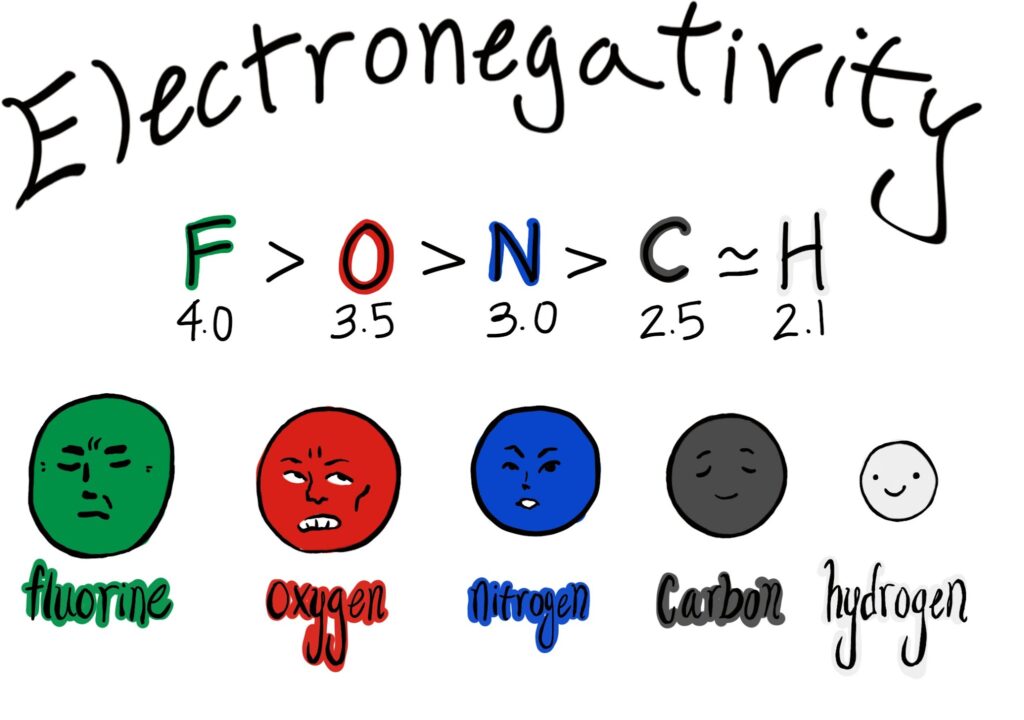
In generale, i metalli sono caratterizzati da raggio atomico relativamente grande, ma hanno bassi valori di energia di ionizzazione, affinità elettronica ed elettronegatività. Tali proprietà li rendono elementi in grado di formare legami stabili con altri atomi. Quindi possiamo dire che sono elementi particolarmente reattivi.
Bene, passiamo alla controparte destra della tavola periodica.
I non metalli hanno un raggio atomico generalmente ridotto, alta energia di ionizzazione, alta affinità elettronica ed elettronegatività.
Infatti, il raggio atomico di tali elementi diminuisce lungo un periodo, ma aumenta lungo un gruppo. Cosa significa? Diventano più piccoli da sinistra a destra, ma guadagnano in grandezza verso il basso.
La loro energia di ionizzazione è elevata e quindi tali elementi hanno necessità di una grande quantità di energia per rimuovere un elettrone dall’atomo.
Ciò significa che gli atomi non metallici diventano più stabili da sinistra a destra e diventano più reattivi verso il basso (lungo un gruppo).
Anche per questi elementi l’affinità elettronica e l’elettronegatività vanno in tandem 🚴.
Infatti, gli atomi della parte destra sono inclini a guadagnare elettroni e quindi hanno una buona capacità di attrarre cariche energetiche verso di sé in un legame chimico.
A causa, o per merito, di queste proprietà, possiamo dire che i non metalli sono elementi poco reattivi.

Infatti, a questa categoria appartengono anche i gas nobili (gruppo 18). Gli elementi di questo gruppo hanno una configurazione elettronica molto stabile e quindi tendono a essere chimicamente inattivi.
Cosa vuol dire semimetalli?
I semimetalli sono elementi che presentano caratteristiche sia metalliche, sia non metalliche.
Gli elementi di questa terza categoria sono posizionati sulla linea di separazione tra metalli e non metalli.
In questa aggregazione rientrano boro, silicio, germanio, arsenico, antimonio, tellurio e polonio.
Hai capito bene, solo sette elementi. Ti consigliamo di impararli a memoria perché sono pochi e possono aiutarti a orientarti meglio nella lettura della tavola periodica (o durante un quiz del TOLC 🥶).
Come avrai capito, sono elementi caratterizzati da raggio atomico, energia di ionizzazione ed elettronegatività intermedi con una bassa affinità elettronica.
Tali caratteristiche li rendono buoni semiconduttori in grado di formare legami stabili con gli atomi delle altre due categorie e anche con altri semimetalli.
Il raggio atomico dei semimetalli varia in modo irregolare lungo gruppi e periodi, ma è (in generale) maggiore rispetto a quello dei non metalli.
L’energia di ionizzazione è generalmente inferiore rispetto a quella dei non metalli, ma superiore rispetto a quella dei metalli.
Ciò significa che gli atomi di questa categoria diventano più reattivi man mano che andiamo da sinistra a destra lungo un periodo, ma diventano più stabili quando scendiamo verso il basso lungo un gruppo.
Per quanto riguarda l’affinità elettronica, il valore dei semimetalli varia in modo irregolare, ma possiamo dire che in generale questi elementi tendono ad avere un valore basso relativamente a tale proprietà.
L’elettronegatività, come detto sopra, è intermedia e ciò significa che gli atomi di questo tipo possono formare legami chimici con quasi tutti gli elementi.
Come faccio a distinguere i metalli dai non metalli e semimetalli?
Per distinguere rapidamente tra metalli, non metalli e semimetalli ti consigliamo di utilizzare questo piccolo tip.
Fai la differenza tra il numero di elettroni nel guscio elettronico più esterno e il periodo di appartenenza di un elemento, se il risultato è:
- maggiore o uguale a 0, l’elemento appartiene ai metalli;
- compreso tra -2 e 0, l’elemento è tra i semimetalli,
- minore di -2, l’elemento è tra i non metalli.

Vediamo un esempio:
Il magnesio (Mg) è nel periodo 3 e ha la configurazione di valenza è 3s2.
Cioè, nel livello energetico più esterno il magnesio ha 2 elettroni (entrambi nell’orbitale 3s).
Facendo la differenza tra livello energetico ed elettroni di valenza otteniamo 3-2 = 1.
Come sappiamo, la matematica non è un’opinione e quindi il magnesio appartiene alla categoria dei metalli.
Fai attenzione però, ci sono alcune eccezioni. Per esempio, l’idrogeno è un non metallo anche se la sottrazione da come risultato 0. Stesso discorso vale per germanio (Ge), antimonio (An) e polonio (Po), che sono semimetalli pur avendo 0 come risultato della differenza.
Dal mondo della tavola periodica è tutto per ora. Se vuoi approfondire queste tematiche trovi un’intera playlist dedicata sul nostro canale YouTube.
Ciao doctorz, alla prossima! 😉✌️




